pembahasan selanjutnya adalah

Pembahasan soal Kimia Tes Kompetensi Akademik Sains dan Teknologi (TKA Saintek) pada Ujian Tulis Berbasis Komputer (UTBK) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2019 nomor 46 sampai dengan nomor 50 tentang:
- stoikiometri,
- larutan penyangga,
- kesetimbangan kimia,
- energetika, dan
- minyak bumi.
Soal No. 46 tentang Stoikiometri
2MnO4− + 5C2O42− + 16H+ → Mn2+ + 10CO2 + 8H2O
Volume gas CO2 yang dihasilkan diukur pada 0 ℃ dan 76 mmHg adalah ….
| A. | 0,112 L |
| B. | 0,224 L |
| C. | 0,336 L |
| D. | 0,448 L |
| E. | 0,560 L |
Pembahasan
Jumlah mol MnO4− atau KMnO4 adalah:
| n MnO4− | = | M ∙ V |
| = | 0,2 M × 20 mL | |
| = | 4 mmol |
Berdasarkan koefisien reaksi di atas, jumlah gas CO2 adalah:
| n CO2 | = | 10/2 × n MnO4− |
| = | 5 × 4 mmol | |
| = | 20 mmol | |
| = | 2 × 10−2 mol |
Dengan demikian, volume gas CO2 diukur pada 0 ℃ dan 76 mmHg (keadaan STP) adalah:
| V CO2 | = | n ∙ 22,4 L |
| = | 2 × 10−2 × 22,4 L | |
| = | 0,448 L |
Jadi, volume gas CO2 yang dihasilkan diukur pada keadaan STP adalah 0,448 L (D).
Soal No. 47 tentang Larutan Penyangga

Berdasarkan ilustrasi molekuler di atas, apabila spesi-spesi tersebut dibiarkan bereaksi, ilustrasi molekuler yang membentuk larutan penyangga adalah ….
| A. | a |
| B. | b |
| C. | c |
| D. | a dan b |
| E. | a dan c |
Pembahasan
HA bersifat asam dengan pKa = 4 atau Ka = 10−4. Hal ini menunjukkan bahwa HA adalah asam lemah (asam kuat Ka = 1).
Terbentuknya larutan penyangga pada ilustrasi di atas bila mol asam lemah lebih besar dari mol basa kuat.
Mari kita perhatikan jumlah butiran masing-masing, 1 butir = 0,1 mol.
| a | : | 0,6 asam lemah + 0,6 basa kuat [terjadi hidrolisis] |
| b | : | 0,5 asam lemah + 0,8 basa kuat [tidak terbentuk larutan penyangga] |
| c | : | 1,0 asam lemah + 0,3 basa kuat [terbentuk larutan penyangga] |
Jadi, ilustrasi molekuler yang membentuk larutan penyangga adalah gambar c (C).
Soal No. 48 tentang Kesetimbangan Kimia
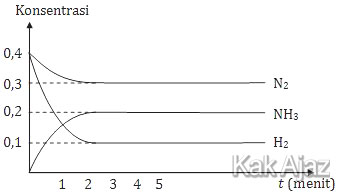
Jika pada menit ke-3 ditambahkan N2 maka:
| A. | kesetimbangan bergeser ke arah reaktan |
| B. | N2 bertambah |
| C. | NH3 bertambah |
| D. | H2 bertambah |
| E. | tidak terjadi pergeseran kesetimbangan |

Pembahasan
Berdasarkan grafik di atas, N2 dan H2 adalah reaktan (ruas kiri) karena pada keadaan awal konsentrasinya sudah ada. Sedangkan NH3 adalah produk (ruas kanan) karena pada keadaan awal konsentrasinya masih nol.
N2 + H2 ⇌ NH3
Pada detik ke-3, reaksi sudah dalam keadaan setimbang (grafik lurus mendatar). Jika pada detik ke-3 ditambahkan N2 maka reaksi akan bergeser ke kanan (produk) untuk mencapai kesetimbangan baru. [opsi A dan E salah]
Akibat reaksi bergeser ke kanan adalah:
- konsentrasi N2 berkurang [opsi B salah]
- konsentrasi NH3 bertambah [opsi C benar]
Jadi, jika pada menit ke-3 ditambahkan N2 maka konsentrasi NH3 bertambah (C).
Soal No. 49 tentang Energetika

Pernyataan yang benar tentang grafik di atas adalah ….
| A. | A + B bisa langsung membentuk P |
| B. | A + B membentuk P melalui dua kompleks teraktifkan yaitu AB* dan C* |
| C. | Reaksi A + B → P melepaskan energi sebesar (E – F) |
| D. | Reaksi A + B → P melepaskan energi sebesar (F – D) |
| E. | Reaksi A + B → P adalah reaksi eksoterm |
Pembahasan
Mari kita ulas setiap pernyataan di atas berdasarkan grafik!
- A + B tidak bisa langsung membentuk P, tetapi membentuk C terlebih dahulu [opsi A salah]
- A + B → C melalui kompleks teraktifkan AB* sedangkan C → P melalui kompleks teraktifkan C* [opsi B benar]
- A + B → P menyerap kalor sebesar ∆H = F – D [opsi C dan D salah]
- Karena ∆H bernilai positif maka reaksi adalah reaksi endoterm [opsi E salah]
Jadi, pernyataan yang benar tentang grafik di atas adalah opsi (B).
Soal No. 50 tentang Minyak Bumi
| A. | menurunkan tekanan uap bensin |
| B. | meningkatkan viskositas bensin |
| C. | meningkatkan titik nyala bensin |
| D. | menurunkan titik didih bensin |
| E. | menaikkan tingkat oksidasi bensin |
Pembahasan
Tujuan penambahan toluena pada bensin bebas timbal adalah untuk meningkatkan bilangan oktan dan anti-knocking. Knocking atau ketukan dalam mesin adalah terbakarnya uap bensin secara spontan sebelum adanya percikan api dari busi. Hal ini terjadi karena tekanan uap bensin sangat tinggi.
Toluena yang bersifat anti-knocking akan menurunkan tekanan uap bensin sehingga bensin terbakar tepat saat ada percikan api dari busi, mesin terhindar dari knocking, serta residu bensin berkurang.
Jadi, tujuan penambahan toluena ke dalam bensin adalah untuk menurunkan tekanan uap bensin (A).
Simak Pembahasan Soal TKA Saintek UTBK SBMPTN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
