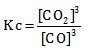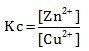Untuk Pembelajaran selanjutnya…
BAGIAN ESSAI
Soal No.31
Diketahui enegi ikatan rata – rata :
C – C = 83,1 kkal mol-1
C = N = 210,0 kkal mol-1
C – H = 99,3 kkal mol-1
C – N = 69,7 kkal mol-1
C ≡ N = 104,2 kkal mol-1
N – H = 93,4 kkal mol-1
H – H = 103,92 kkal mol-1
Hitunglah ∆H reaksi berikut!
C2H5 – C ≡ N + 2H2 → C2H5 – CH2 – NH2
Soal No.32
Gas N2O4 sebanyak 3,2 mol dalam ruang 10 L dipanaskan hingga terurai menurut persamaan reaksi : N2O4(g) → 2NO2 (g)
Setelah 5 detik, dalam ruangan tersebut terdapat 0,8 mol gas NO2. Hitung laju reaksi :
- Peruraian N2O4
- Pembentukan NO2
Soal No.33
Perhatikan reaksi kesetimbangan berikut :
3Fe (s) + 4H2O (g) ⇌ Fe3O4 (s) + 4H2 (g) ∆H = +x kJ
Jelaskan yang akan terjadi apabila ke dalam reaksi kesetimbangan tersebut :
- Suhu diturunkan
- Ditambahkan Fe, dan
- Tekanan diperbesar
PEMBAHASAN :
- Jika suhu diturunkan maka reaksi akan bergeser ke reaksi eksoterm. Di soal nilai ∆H adalah + atau endoterm, maka untuk reaksi eksoterm adalah reaksi ke kiri. Sehingga jika suhu diturunkan reaksi akan bergeser ke kiri ke reaksi eksoterm.
- Penambahan zat padat seperti Fe tidak akan mempengaruhi pergeseran kesetimbangan. Sehingga reaksi tidak akan bergeser ke kiri atau ke kanan.
- Jika tekanan diperbesar maka reaksi akan bergeser ke jumlah koefisien yang kecil. Reaksi di atas merupakan reaksi heterogen, yang dihitung koefisiennya hanya yang berwujud gas. Sehingga koefisien kiri = kanan karena yang dihitung hanya yang wujud gas. Karena koefisien sama maka pengaruh tekanan tidak berpengaruh terhadap pergeseran kesetimbangan.
Soal No.34
Tuliskan rumusan hukum kesetimbangan untuk reaksi kesetimbangan berikut :
- Fe2O3(s) + 3CO (g) ⇌ 2Fe (s) + 3CO2 (g)
- Cu2+(aq) + Zn (s) ⇌ Cu (s) + Zn2+(aq)
PEMBAHASAN :
Menentukan Kc jika reaksi heterogen hanya memasukan wujud gas (g) atau wujud larutan (aq) untuk wujud padat (s) dan cairan (l) tidak dimasukan karena konsentrasinya tidak berubah.
Soal No.35
Dalam ruang 10 liter direaksikan 0,5 mol gas N2 dan 1,5 mol gas H2 hingga terjadi reaksi setimbang :
N2 (g) + H2 (g) ⇌ NH3 (g) (belum setara)
Pada saat setimbang terdapat 0,25 mol gas N2 dan tekanannya 3 atm. Hitung nilai Kc dan Kp!
PEMBAHASAN :
Diketahui reaksi:
Karena tidak diketahui suhu saat reaksi berlangsung maka tidak bisa menentukan Kp lewat rumus Kp hubungannya dengan Kp, tetapi harus menentukan masaing Kc dan Kp nya
Menentukan Kc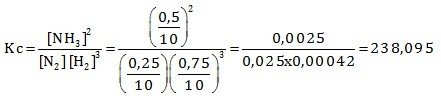
(dibagi 10 karena mol harus dibagi volume untuk menentukan molaritasnya)
Menentukan Kp
Sebelum menentukan Kp terlebih dahulu menentukan tekanan parsial masing-masing zat
n total = 0,25 + 0,75 + 0,5 = 1,5 mol
P total = 3 atm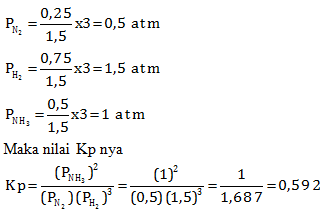
Semoga Bermanfaat