Untuk Pembelajaran selanjutnya…
Halo selamat datang di semester 2. Bab pertama kimia semester 2 untuk kelas 10 adalah larutan elektrolit dan non elektrolit. Larutan itu tidak semuanya dapat menghantarkan listrik yah ada juga yang tidak bisa menghantarkan listrik. Simak rangkuman materi dan contoh soal larutan elektrolit dan non elektrolit untuk kamu kelas 10, jika ingin lebih paham kita buatkan juga video pembelajarannya disini. Selamat belajar
Berdasarkan daya hantar listrik, maka larutan dibagi menjadi dua bagian:
Larutan Elektrolit
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik. Berdasarkan kuat lemahnya larutan elektrolit dibedakan menjadi dua:
Larutan elektrolit kuat
Larutan ini sangat baik dalam menghantarkan listrik. Dalam percobaan uji daya hantar listrik, larutan elektrolit kuat akan menyalakan lampu dengan terang dan menghasilkan gelembung yang banyak. Ciri-ciri dari larutan elektrolit kuat adalah:
- Mengalami ionisasi sempurna, artinya zat elektrolit akan terionisasi keseluruhannya. Hal ini disebabkan karena mengalami reaksi searah atau berkesudahan.
HCl(aq) → H+(aq) + Cl—(aq) - Memiliki Derajat Ionisasi (α) = 1, α merupakan perbandingan antara mol yang terionisasi dengan mol mula-mula. Karena semua mol mula-mula terionisasi maka perbandingannya akan bernilai = 1
- Contohnya : Asam kuat (HCl, HBr, HI, H2SO4, HNO3, HClO4, HClO3), Basa kuat (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, dan sebagian garam.
Larutan elektrolit lemah
Larutan ini kurang baik dalam menghantarkan listrik. Dalam percobaan uji daya hantar listrik, larutan elektrolit lemah akan menyalakan lampu dengan redup bahkan mati tetapi menghasilkan gelembung walaupun sedikit. Ciri-ciri dari larutan elektrolit lemah adalah:
- Mengalami ionisasi sebagian, artinya zat elektrolit akan terionisasi sebagiannya saja. Hal ini disebabkan karena mengalami reaksi kesetimbangan.
HCN(aq) → H+(aq) + CN—(aq) - Memiliki Derajat Ionisasi (α) = 0 < α < 1, α merupakan perbandingan antara mol yang terionisasi dengan mol mula-mula. Karena sebagian mol mula-mula terionisasi maka perbandingannya akan bernilai diantara 0 sampai 1
- Contohnya : Asam lemah (CH3COOH, H3PO4, HCN, HF, dll), Basa lemah (AgOH, Zn(OH)2, NH4OH, dll).
Larutan Non elektrolit
Larutan elektrolit merupakan larutan yang tidak dapat menghantarkan listrik. Ciri-ciri dari larutan non elektrolit adalah:
- Tidak mengalami ionisasi artinya zat non elektrolit hanya terjadi perubahan wujudnya saja tidak berubah menjadi ion.
C6H12O6(s) → C6H12O6(aq) - Memiliki Derajat Ionisasi (α) = 0. Karena mol mula-mula tidak ada yang terionisasi maka perbandingannya akan bernilai diantara 0
- Contohnya : Gula (glukosa C6H12O6, sukrosa C12H22O11), Urea (CO(NH2)2), Alkohol (metanol (CH3OH), etanol (C2H5OH))
Videonya ada 2 part ya. Kalau terlalu kecil tekan opsi full screen di pojok kanan video. Silahkan menyimak!
Soal No.1
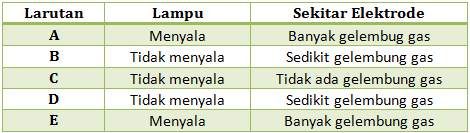
Percobaan pengujian larutan dengan alat uji elektrolit didapatkan hasil sebagai berikut
Dari data di atas, tunjukkan manakah yang termasuk larutan elektrolit dan non-elektrolit, serta larutan elektrolit kuat dan elektrolit lemah. Jelaskan!
PEMBAHASAN :
Termasuk larutan elektrolit : Larutan A, E (Lampu menyala dan banyak gelembung), B dan D ( ada sedikit gelembung)
Elektrolit Kuat : Larutan A, E (Lampu menyala dan banyak gelembung)
Elektrolit Lemah : B dan D (ada sedikit gelembung)
Larutan non elektrolit : Larutan C (Tidak menyala dan tidak ada gelembung gas)
Soal No.2
Tuliskan reaksi peruraian dari larutan K2SO4; HNO3; Fe2(SO4)3; Ba(NO3)2
PEMBAHASAN :
K2SO4 → 2K+ + SO42-
HNO3 → H+ + NO3—
Fe2(SO4)3 → 2Fe3+ + 3SO42-
Ba(NO3)2 → Ba2+ + 2NO3—
Soal No.3
Jelaskan apa yang dimaksud dengan larutan elektrolit dan non elektrolit serta jelaskan mengapa larutan elektrolit dapat menghantarkan listrik
PEMBAHASAN :
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik sedangkan larutan non elektrolit larutan yang tidak dapat menghantarkan listrik. Larutan elektrolit dapat menghantarkan listrik karena dalam larutannya terdapat ion-ion yang dapat melepaskan elektron dan menangkap elektron sehingga elektron dapat mengalir diantara dua kutub.
Soal No.4
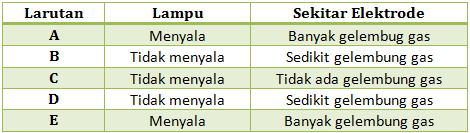
Jika diketahui data pengamatan pengujian daya hantar listrik dengan alat uji sebagai berikut:
Tentukan manakah larutan yang termasuk larutan elektrolit kuat, elektrolit lemah dan non elektrolit, Jelaskan!
PEMBAHASAN :
Hasil daya hantar listrik beberapa larutan dalam uji daya hantar listrik:
- Larutan elektrolit kuat : lampu menyala terang, gelembung banyak.
- Larutan elektrolit lemah : lampu menyala redup/tidak menyala, gelembung sedikit.
- Larutan non elektrolit : lampu tidak menyala, gelembung tidak ada.
Dari ciri-ciri di atas, maka
- Larutan A : larutan non elektrolit
- Larutan B : larutan elektrolit kuat
- Larutan C : larutan elektrolit lemah
- Larutan D : larutan elektrolit lemah
Soal No.5
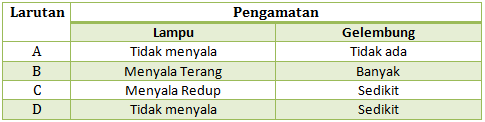
Diketahui 3 buah larutan akan diuji daya hantarnya, lengkapi tabel berikut sesuai dengan jenis larutan elektrolitnya berdasarkan pengamatan lampu dan gelembung
PEMBAHASAN :
- larutan BaSO4 merupakan garam yang termasuk ke dalam larutan elektrolit kuat
- Larutan AgOH merupakan basa lemah yang termasuk kedalam elektrolit lemah
- Larutan C12H22O11 (sukrosa/gula putih) merupakan larutan non elektrolit
Berdasarkan ciri-ciri larutan elektrolit dan non elektrolit pada soal no 2, maka:
- Larutan BaSO4 lampu menyala terang, gelembung banyak.
- Larutan AgOH lampu menyala redup, gelembung sedikit
- Larutan C12H22O11 lampu mati, tidak ada gelembung.
Soal No.6
Tuliskan reaksi ionisasi dari larutan berikut:
a.Ca(NO3)2
b.Zn(OH)2
c.CO(NH2)2
PEMBAHASAN :
a. Ca(NO3)2 → Ca2+ + 2NO3—
b. Zn(OH)2 → Zn2+ + 2OH—
c. CO(NH2)2 → CO(NH2)2 (tidak mengalami ionisasi)
Soal No.7
Urutkan larutan berikut berdasarkan daya hantar listriknya
- HBr 0,1 M
- H2SO4 0,1 M
- NH3 0,1 M
- C2H5OH
PEMBAHASAN :
HBr dan H2SO4 merupakan larutan elektrolit kuat, NH3 merupakan larutan elektrolit lemah sedangkan C2H5OH merupakan larutan non elektrolit. HBr dan H2SO4 keduanya merupakan elektrolit kuat dengan molaritas yang sama. H2SO4 lebih kuat elektrolitnya karena mengandung ion yang lebih banyak.
H2SO4 → 2H+ + SO42- (3 ion)
HBr → H+ + Br— (2 ion)
Soal No.8
Mengapa garam dapur padat tidak dapat menghantarkan listrik sedangkan garam dapur cair dan larutan garam dapur dapat menghantarkan listrik.
PEMBAHASAN :
Garam dapur (NaCl) merupakan senyawa ion yang termasuk larutan elektrolit kuat. Senyawa ion jika dalam bentuk padat belum memiliki ion-ion yang bergerak bebas. Sedangkan dalam bentuk cair dan larutannnya NaCl sudah memiliki ion-ion yang dapat menghantarkan listrik
Soal No.9
Tentukan apakah zat-zat berikut tergolong elektrolit atau non elektrolit
- aseton
- alkohol
- larutan NaCl
- larutan urea
- larutan cuka
- larutan gula
- air laut
PEMBAHASAN :
Yang termasuk larutan elektrolit:
- air laut (elektrolit kuat)
- larutan cuka (elektrolit lemah)
- larutan NaCl (elektrolit kuat)
Yang termasuk larutan non elektrolit
- larutan gula
- larutan urea
- aseton
- alkohol
Soal No.10
Sebutkan masing-masing 10 macam larutan elektrolit kuat, larutan elektrolit lemah dan larutan non elektrolit
PEMBAHASAN :
Larutan Elektrolit kuat:
- larutan garam (NaCl)
- air laut
- Larutan H2SO4
- Larutan HBr
- Larutan HCl
- Larutan HI
- Larutan HNO3
- Larutan KI
- Larutan BaCl2
- Larutan HClO4
Larutan Elektrolit lemah:
- Larutan cuka (CH3COOH)
- Larutan HCN
- Larutan amoniak (NH4OH)
- Larutan AgOH
- Larutan HF
- Larutan H2S
- Larutan Fe(OH)3
- Larutan Zn(OH)2
- Larutan Al(OH)3
- Larutan HNO2
Larutan Non Elektrolit
- Larutan gula (C12H22O11)
- Larutan Urea (CO(NH2)2)
- Larutan Aseton (C3H6O)
- Etanol (C2H5OH)
- Metanol (CH3OH)
- Larutan glukosa (C6H12O6)
- Larutan Fruktosa
- Propanol (C3H7OH)
- Butanol (C4H9OH)
- n-heksana
Soal No.11
Apa yang membedakan kekuatan elektrolit?
PEMBAHASAN :
elektrolit dibagi menjadi dua yaitu elektrolit kuat dan elektrolit lemah. Elektrolit kuat dan lemah dibedakan berdasarkan jumlah ion yang dihasilkan ketika mengalami reaksi ionisasi. Perbedaan jumlah ion pada jumlah yang sama (konsentrasi sama) menyebabkan perbedaan daya hantar listriknya berbeda. Pada konsentrasi yang sama elektrolit kuat dapat menyalakan lampu dengan terang dan menghasilkan gelembung yang banyak sedangkan elektrolit lemah menyalakan lampu hingga redup atau bisa saja mati tapi menghasilkan gelembung walaupun sedikit.
Soal No.12
Manakah larutan yang menghantarkan listrik lebih baik? Jelaskan
- HCl 1 M atau HCl 2 M
- HCl 1 M atau CH3COOH 1 M
- HCl 1 M atau H2SO4 1 M
PEMBAHASAN :
- HCl 1 M atau HCl 2 M
Untuk zat yang sama, maka kekuatan daya hantar listrik dilihat dari besarnya konsentrasi atau molaritas. Semakin besar konsentrasi semakin banyak ionnnya sehingga semakin kuat menghantarkan listrisnya. Maka HCl 2 M larutan yang menghantarkan listriknya lebih baik. - HCl 1 M atau CH3COOH 1 M
Pada konsentrasi sama maka HCl merupakan larutan yang menghantarkan listrisnya lebih baik. Larutan HCl merupakan larutan elektrolit kuat yang jika terionisasi akan terionisasi sempurna sedangkan larutan CH3COOH termasuk larutan elektrolit lemah jika terionisasi maka akan mengalami terionisasi sebagian. - HCl 1 M atau H2SO4 1 M
Larutan HCl dan H2SO4 keduanya merupakan larutan elektrolit kuat namun kekuatan elektrolit juga dipengaruhi oleh jumlah ion. Semakin banyak jumlah ion semakin kuat larutan elektrolitnya. HCl memiliki 2 ion yaitu H+ dan Cl— sedangkan H2SO4 memiliki 3 ion yaitu 2H+ dan SO42- , sehingga pada konsentrasi yang sama H2SO4 memiliki sifat elektrolit yang lebih kuat dibanding HCl.
Soal No.13
Jelaskan kenapa kristal NaCl tidak dapat menghantarkan listrik namun larutannya dalam air dapat menghantarkan listrik.
PEMBAHASAN :
Kristal NaCl sudah memiliki ion-ion di dalamnya namun tidak dapat bergerak bebas. Sedangkan jika dilarutkan ke dalam air ion-ion NaCl dapat bergerak bebas dan dapat mengalirkan elektron sehingga dapat menghantarkan listrik.
Soal Pilihan Ganda
Soal No.14
Larutan dapat menghantarkan listrik jika larutan tersebut memiliki….
- partikel yang bergerak bebas
- molekul-molekul yang bergerak bebas
- kemampuan larut dalam air
- atom-atom yang bergerak bebas
- ion-ion yang bergerak bebas
PEMBAHASAN :
Suatu larutan dapat menghantarkan listrik jika di dalamnya terdapat ion-ion yang bergerak bebas. Ion-ion ini ada yang melepaskan elektron dan menerima elektron sehingga terjadi pergerakan elektron antara dua kutub yang akan terus mengalirkan listrik. Pada larutan non elektrolit tidak terdapat ion-ion bebas sehingga elektron akan terhenti di salah satu kutub.
Soal No.15
Larutan A di uji dengan alat uji larutan elektrolit, lampu pada alat uji mati tapi menghasilkan sedikit gelembung pada elektroda. Larutan lain yaitu larutan B menyebabkan lampu pada alat uji menyala terang dan menghasilkan gelembung yang banyak di elektroda. Dari pengamatan tersebut dapat disimpulkan bahwa….
- Larutan A elektrolit lemah, larutan B elektrolit kuat
- Larutan A elektrolit kuat, larutan B elektrolit lemah
- Larutan A non elektrolit, larutan B elektrolit kuat
- Larutan A elektrolit lemah, larutan B non elektrolit
- Larutan A non elektrolit, larutan B elektrolit lemah
PEMBAHASAN :
Larutan A lampu pada alat uji mati tetapi menghasilkan gelembung walaupun sedikit dapat disimpulkan termasuk larutan elektrolit lemah, elektrolit lemah dapat menyebabkan lampu menyala redup atau mati tetapi menghasilkan gelembung udara di elektroda. Larutan B termasuk elektrolit kuat karena menyebabkan lampu pada alat uji menyala terang dan menghasilkan gelembung udara yang banyak.
Jawaban A
Soal No.16
Diantara senyawa berikut yang dalam keadaan padat tidak dapat menghantar listrik, tetapi dalam keadaan cair dan larutan dapat menghantar listrik adalah….
- NaCl dan HBr
- NaCl dan KBr
- HBr dan HCl
- gula dan urea
- H2SO4 dan KCl
PEMBAHASAN :
Zat yang dalam keadaan padat tidak menghantar dan pada keadaan cair dan larutan mengantar listrik adalah senyawa ion. Senyawa ion tersusun dari unsur logam dan logam. Yang termasuk senyawa ion adalah NaCl dan KBr. Sedangkan HBr, H2SO4, HCl, termasuk kedalam senyawa kovalen polar yang dapat menghantar listrik pada keadaan larutan. sedangkan gula dan urea termasuk kovalen non polar sehingga tidak dapat menghantar pada wujud apapun
Jawaban B
Soal No.17
Reaksi ionisasi dari larutan H2SO4 adalah….
- H2SO4 (aq) → 2H+ (aq) + 4SO2— (aq)
- H2SO4 (aq) → H2+ (aq) + 4SO2— (aq)
- H2SO4 (aq) → 2H+ (aq) + SO42- (aq)
- H2SO4 (aq) → H2+ (aq) + SO42- (aq)
- H2SO4 (aq) →H2+ (aq) +4SO2— (aq)
PEMBAHASAN :
Reaksi ionisasi larutan H2SO4 adalah
H2SO4 (aq) → 2H+ (aq) + SO42- (aq)
Jawaban C
Soal No.19
Senyawa berikut yang larutannya memiliki jumlah ionnya paling banyak adalah….
PEMBAHASAN :
- K2SO4 → 2K+ + SO42-, Jumlah ionnya ada 3 ion
- AgCl → Ag+ + Cl—, Jumlah ionnya ada 2 ion
- HBr → H+ + Br— , Jumlah ionnya ada 2 ion
- CO(NH2)2, tidak mengalami ionisasi
- HCN ⇔ H+ + CN— , Jumlah ionnya ada 2 ion
Jawaban A
Soal No.20
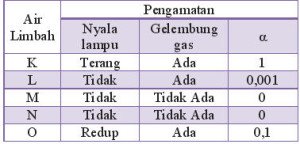
Pasangan air limbah yang bersifat elektrolit kuat dan non elektrolit adalah…
- K dan M
- K dan L
- L dan M
- L dan O
- L dan N
PEMBAHASAN :
Ciri elektrolit kuat:
– Nyala lampu terang
– Gelembung banyak
– derajat ionisasi (α) =1
Ciri elektrolit lemah:
– nyala lampu redup/mati
– gelembung sedikit
– derajat ionisasi 0<α<1
Ciri non elektrolit:
– nyala lampu mati
– tidak ada gelembung
– α = 0
Jawaban A
Gimana belajar larutan elektrolit & non elektrolitnya, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Ok demikian rangkuman materi dan contoh soal larutan elekrolit dan non elektrolit berikut video pembelajarannya. Semoga berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.
Sumber Soal : Kelas X Penerbit Erlangga Pengarang Unggul Sudarmo
Semoga Bermanfaat