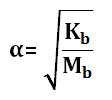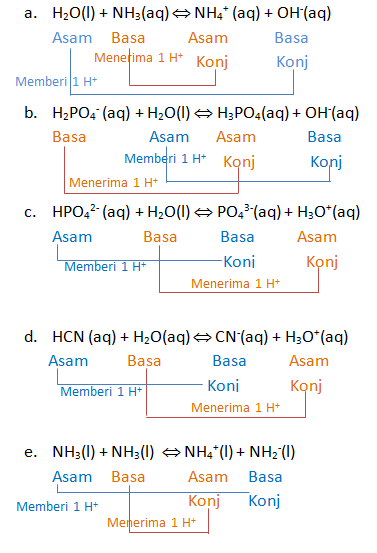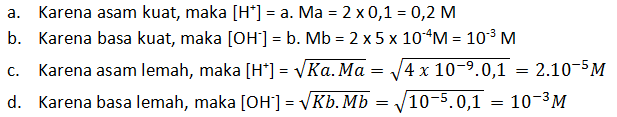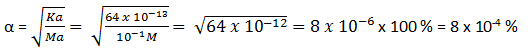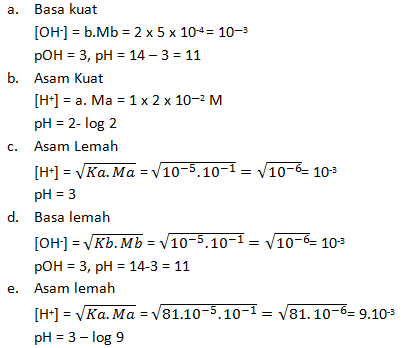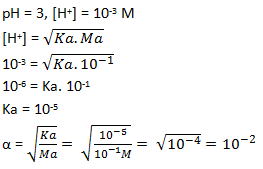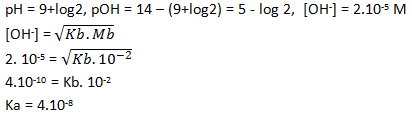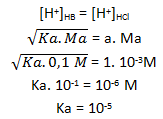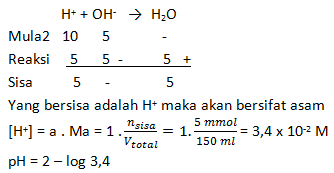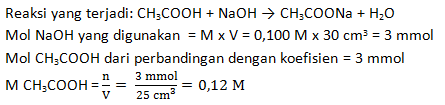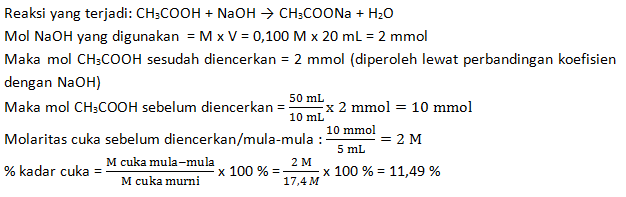Untuk Pembelajaran selanjutnya…
Halo selamat datang di semester 2. Bab awal kimia semester 2 untuk kelas 11 adalah asam basa. Di SMP mungkin kalian sudah belajar sedikit mengenai asam basa kali ini kita mau bantu kamu dengan membuat rangkuman materi dan contoh soal asam basa dan titrasi. Kumpulan pertanyaan tentang asam dan basa berikut pembahasan asam basa. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini dan terakhir coba latihan soal asam basa yah. Selamat belajar
Teori Asam Basa
Teori Arhenius
Asam : Zat yang dimasukan ke dalam air menghasilkan ion H+, contoh:
HCl(aq) ® H+ (aq) + Cl—(aq)
Basa : Zat yang dimasukan ke dalam air menghasilkan ion OH—, contoh:
KOH (aq) ® K+(aq) + OH(aq)
Teori Bronsted-Lowry
Asam : Zat yang bertindak sebagai donor/pemberi proton (H+)
Basa : Zat yang bertindak sebagai akseptor/penerima proton (H+)
Contoh:
Basa Asam
NH3(g) + H2O(l) ®NH4+(aq) + OH—(aq)
Melepas 1 H+
Menangkap 1 H+
Teori Lewis
Asam : Zat yang bertindak sebagai akseptor/penerima pasangan elektron
Basa : Zat yang bertindak sebagai donor/pemberi pasangan elektron
Contoh:
NH3(g) + BF3(g) ® H3N–BF3(s)
Dalam reaksi tersebut, BF3 bertindak sebagai akspetor pasangan elektron
Asam
Terbagi menjadi dua:
Asam Kuat
Mengalami ionisasi sempurna dalam air
Memiliki derajat ionisasi (α) = 1
Contohnya: H2SO4, HCl, HBr, HI, HNO3, HClO4
Rumus penentuan pH:
[H+] = a. Ma
Ket : a = valensi asam (jumlah H+)
Ma = Molaritas Asam
pH = – log [H+]
Jika [H+] = 10-a maka pH = a
Jika [H+] = b. 10-a maka pH = a – log b
Asam Lemah
Mengalami ionisasi sebagian dalam air
Memiliki derajat ionisasi 0<α<1, rumus menentukan α: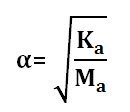
Contohnya : HCN, HF, H3PO4, CH3COOH, dll
Rumus penentuan pH:
pH = – log [H+]
Jika [H+] = 10-a maka pH = a
Jika [H+] = b. 10-a maka pH = a – log b
BASA
Basa Kuat
Mengalami ionisasi sempurna dalam air
Memiliki derajat ionisasi (α) = 1
Contohnya : LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2
Rumus penentuan pH:
[OH—] = b. Mb
Ket : b = valensi basa(jumlah OH—)
Mb = Molaritas Basa
pOH = – log [OH—]
Jika [OH—] = 10-a maka pOH = a
Jika [OH—] = b. 10-a maka pOH = a – log b
pH = 14 – pOH
Basa Lemah
Mengalami ionisasi sebagian dalam air
Memiliki derajat ionisasi 0<α<1, rumus menentukan α :
Contohnya : NH4OH, AgOH, Fe(OH)2, Fe(OH)3, Mg(OH)2,dll
Rumus penentuan pH:
pOH = – log [OH—]
Jika [OH—] = 10-a maka pOH = a
Jika [OH—] = b. 10-a maka pOH = a – log b
pH = 14 – pOH
TITRASI
-
Merupakan metode analisis kuantitatif untuk menentukan kadar suatu larutan.
-
Jika zat yang akan ditentukan kadarnya adalah larutan asam maka harus dititrasi oleh larutan basa, begitu pula sebaliknya.
Perhitungan Titrasi
-
Perhitungan titrasi berguna menentukan konsentrasi larutan asam / basa yang diperoleh
dari hasil titrasi pada keadaan titik ekuivalen.
-
Titik ekuivalen terjadi pada saat asam tepat bereaksi dengan basa, dan sebaliknya.
Berlaku hubungan:
Jumlah gram ekuivalen (grek) asam = Jumlah gram ekuivalen (grek) basa
Dengan :
Jumlah grek asam = Va x Na
Jumlah grek basa = Vb x Nb
Na = Normalitas Asam (N), Va = Volume asam (L)
Nb = Normalitas Basa (N), Vb = Volume basa (L)
- Sehingga berlaku hubungan:
Va x Na = Vb x Nb
-
Hubungan normalitas dan molaritas
Na = Ma x a
Nb = Mb x b
-
Sehingga berlaku hubungan:
Va x Ma x a = Vb x Mb x b
Dengan :
Ma = molaritas asam;
a = valensi asam/jumlah ion H+
Mb = molaritas basa;
b = valensi basa/jumlah ion OH—
- AsBas Part 1
- AsBas Part 2
- AsBas Part 3
- Titrasi Part 1
- Titrasi Part 2
- Titrasi Part 3
Soal No.1
Bagaimana cara mengenali suatu larutan bersifat asam asam atau basa?
PEMBAHASAN :
Dengan menggunakan suatu alat yang dapat membedakan mana asam atau basa yang disebut indikator
Soal No.2
A. Jelaskan apa yang dimaksud dengan indikator asam basa
B. Jelaskan persyaratan suatu zat dapat digunakan sebagai indikator asam-basa
PEMBAHASAN :
A. suatu bahan atau alat yang dapat menentukan sifat asam / basa suatu larutan
B. persyaratan suatu zat dapat digunakan sebagai indikator yaitu memiliki warna yang berbeda ketika dimasukan ke dalam larutan asam atau ke larutan basa
Soal No.3
Tuliskan 5 contoh bahan alam yang dapat digunakan untuk indikator asam-basa
PEMBAHASAN :
Kembang sepatu
Kol ungu
Kunyit
Daun pandan
Bunga kertas
Soal No.4
Apa yang dimaksud dengan asam basa menurut Arrhenius, tuliskan contohnya
PEMBAHASAN :
Asam : Zat yang dimasukan ke dalam air akan menghasilkan ion H+
Contoh :
Asam
HCl → H+ + Cl—
Basa
NaOH → Na+ + OH—
Basa : Zat yang dimasukan ke dalam air akan menghasilkan ion OH—
Soal No.5
Lengkapi persamaan reaksi ionisasi asam/ basa berikut:
a. CH3COOH(aq) →
b. H2CO3(aq) →
c. HNO3(aq) →
d. NH4OH(aq) →
e. Ca(OH)2 →
PEMBAHASAN :
a. CH3COOH(aq) → CH3COO—(aq) + H+(aq)
b. H2CO3(aq) → 2H+(aq) + CO32-(aq)
c. HNO3(aq) → H+(aq) + NO3(aq)
d. NH4OH(aq) → NH4+(aq) + OH—(aq)
e. Ca(OH)2 → Ca2+(aq) + 2OH—(aq)
Soal No.6
Tuliskan perbedaan asam lemah dan asam kuat menurut teori asam-basa Arrhenius
PEMBAHASAN :
Asam lemah : asam yang derajat ionisasinya lebih kecil dibanding asam kuat atau kurang terurai dan sedikit menghasilkan ion H+ dalam larutannya
Asam kuat : asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H+ dalam larutannya
Soal No.7
Tuliskan pengertian asam basa menurut Bronsted-Lowry
PEMBAHASAN :
Asam : pemberi/donor proton (H+)
Basa : penerima/akseptor proton (H+)
Soal No.8
Tentukan spesi yang bertindak sebagai asam dan basa dan pasangan asam-basa konjugasinya
a. H2O(l) + NH3(aq) ⇔ NH4+ (aq) + OH‑(aq)
b. H2PO4— (aq) + H2O(l) ⇔ H3PO4(aq) + OH—(aq)
c. HPO42- (aq) + H2O(l) ⇔ PO43-(aq) + H3O+(aq)
d. HCN (aq) + H2O(aq) ⇔ CN—(aq) + H3O+(aq)
e. NH3(l) + NH3(l) ⇔ NH4+(l) + NH2—(l)
Soal No.9
Apa yang dimaksud asam-basa menurut teori lewis dan tuliskan contohnya
PEMBAHASAN :
Asam : Penerima/akseptor pasangan elektron
Basa : Pemberi/donor pasangan elektron
Contoh:
NH3 + BF3 → NH3BF3
Basa asam
NH3 memberikan pasangan elektron bebasnya ke BF3 yang tidak oktet
Soal No.10
Jelaskan kelebihan teori asam-basa Arrhenius, Bronsted-Lowry, dan Lewis
PEMBAHASAN :
Kelebihan Arrhenius : mampu menjelaskan proses netralisasi lebih baik dibanding teori-teori sebelumnya
Kelebihan Brosted-Lowry : Dapat menjelaskan basa yang tidak memiliki ion OH— dan tidak terbatas pada pereaksi air.
Kelebihan Lewis : Dapat menjelaskan asam yang tidak memiliki ion H+, dapat menjelaskan asam basa tanpa ada H+ dan OH—
Soal No.11
Jelaskan sifat asam dan basa dan tentukan pula pasangan asam-basa konjugasi dari larutan tersebut
a. CH3COOH
b. NaOH
PEMBAHASAN :
a. CH3COOH = bersifat asam. Basa konjugasinya adalah CH3COO—
b. NaOH = bersifat basa. Asam konjugasinya adalah Na+
Soal No.12
Jelaskan bagaimana larutan H2PO4— dalam air dapat bersifat asam dan dapat pula bersifat basa
PEMBAHASAN :
Bersifat asam dengan melepaskan 1H+
H2PO4— → HPO42-
Bersifat basa dengan menerima 1 H+
H2PO4 – → PO42-
Soal No.13
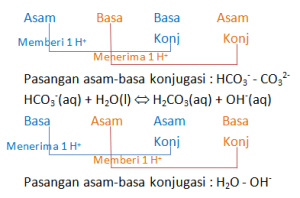
Perhatikan reaksi yang terjadi pada ion bikarbonat berikut
HCO3—(aq) + H2O(l) ⇔ CO32-(aq) + H3O+(aq)
HCO3—(aq) + H2O(l) ⇔ H2CO3(aq) + OH—(aq)
Tentukan pasangan asam-basa konjugasi pada reaksi di atas
Soal No.14
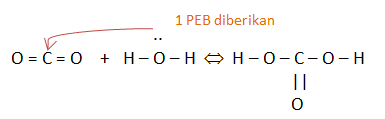
Konsep asam basa menurut Lewis dapat digunakan untuk menjelaskan reaksi asam-basa yang terjadi pada:
CO2(g) + H2O(l) ⇔ H2CO3(aq)
Gambarkan struktur Lewis dari reaksi tersebut. Jelaskan manakah molekul yang bertindak sebagai asam dan sebagai basa
Yang bertindak sebagai asam yaitu CO2 karena menerima pasangan elektron sedangkan yang bertindak sebagai basa yaitu H2O karena memberikan 1 pasangan elektron
Soal No.15
Jelaskan kelemahan dari konsep asam-basa Bronsted-Lowry
PEMBAHASAN :
Tidak mampu menjelaskan reaksi asam basa yang tidak melibatkan proton (H+)
Soal No.16
Jika nilai Kw pada 100oC dianggap 10-12, berapa konsentrasi ion H+ dan OH— dalam air murni pada suhu tersebut!
PEMBAHASAN :
Kw = [H+].[OH—]
10-12 = [H+].[OH—]
Reaksi swaionisasi air
H2O ⇔ H+ + OH—
Karena koefisiennya sama maka, [H+] = [OH—]
10-12 = [H+].[H+]
10-12 = [H+]2
[H+] = ![]() = 10-6 M
= 10-6 M
Maka [OH—] = 10-6 M
Soal No.17
Hitunglah konsentrasi ion H+ dan ion OH— dalam:
a. Larutan H2SO4 0,1 M
b. 100 mL larutan Ba(OH)2 5 x 10-4 M
c. Larutan HBrO 0,1 M Ka = 4 x 10-9
d. Larutan NH3 0,1 M Kb = 10-5
Soal No.18
Hitunglah berapa persen HCN yang terionisasi dalam larutan HCN 0,1 M jika diketahui nilai Ka HCN = 6,4 x 10-12
Soal No.19
Hitunglah konsentrasi masing-masing spesi dalam larutan asam lemah H2CO3 0,1 M jika diketahui Ka1 = 4,2 x 10-7 dan Ka2 = 4,8 x 10-11
Soal No.20

Tentukan:
a. Asam yang paling kuat dan yang paling lemah
b. Urutan kekuatan asam dari yang paling lemah ke yang paling kuat
PEMBAHASAN :
- Rumusan [H+] untuk asam lemah yaitu [H+] = , dimana nilai Ka berbanding lurus dengan [H+], semakin besar Ka maka [H+] semakin besar artinya semakin kuat asamnya begitu pula sebaliknya. Jadi untuk menentukan mana yang paling kuat berarti Ka yang paling besar yaitu HIO3 (Ka = 1,6 x 10-1). Sedangkan yang paling lemah berarti nilai Ka nya kecil yaitu HbrO (Ka = 2,3 x 10-9)
- Asam dari yang paling lemah ke yang paling kuat (Ka kecil ke Ka besar)
HBrO – C6H5COOH – HF – HClO2 – HIO3
Soal No.21
Hitunglah pH larutan :
a. Ba(OH)2 0,0005 M
b. HCl 0,02 M
c. CH3COOH 0,1 M (Ka = 10-5)
d. NH3 0,1 M (Kb = 10-5)
e. HF 0,1 M (Ka = 8,1 x 10-4)
Soal No.22
Larutan HA 0,1 M mempunyai pH = 3. Hitunglah nilai Ka dan derajat ionisasi (α) asam tersebut.
Soal No.23
Suatu basa lemah BOH 0,01 M mempunyai nilai pH = 9+log 2. Hitunglah nilai Kb basa tersebut.
Soal No.24
Larutan asam klorida (HCl) 0,1 M dan larutan H2SO4 0,1 M dengan volume yang sama dicampur menjadi satu. Hitunglah pH campuran larutan tersebut
PEMBAHASAN :
Misal :
Volume HCl = v mL
Volume H2SO4 = v mL
maka nH+total = nH+1 + nH+2
nH+1 dari HCl
nH+1 = a . Ma. V = 1 x 10-1 . V = 10-1 V
nH+2 dari H2SO4
nH+2 = a . Ma.V = 2 x 10-1 V
nH+total = nH+1 + nH+2 = 0,1V + 0,2V = 0,3V
[H+] = n/V total = 0,3 V/ (V +V) = 0,3/2 = 0,15 = 1,5 x 10-1
pH = 1 – log 1,5
Soal No.25
Sebanyak 400 mL larutan mempunyai pH = 1 dicampur dengan 100 mL larutan yang mempunyai pH = 2. Hitunglah pH campuran yang terjadi
Soal No.26
Indikator Hin memiliki Ka = 10-5. Jika HIn berwarna merah dan In— berwarna kuning, pH berapa indikator akan berwarna merah dan pH berapa berwarna kuning?
PEMBAHASAN :
Agar warna larutan berwarna HIn maka pH larutan harus lebih kecil dari pKa dan jika ingin berwarna In— maka pH larutan harus lebih besar dari pKa. Jika Ka = 10-5 maka pKa nya = 5. Untuk berwarna merah (HIn) maka pHnya harus lebih kecil dari 5 (pH < 5). Sedangkan untuk berwarna kuning (In—) maka pHnya harus lebih besar dari 5 (pH > 5)
Soal No.27
Suatu larutan yang bersifat asam HB 0,1 M memiliki warna yang sama ketika ditetesi dengan indikator universal dengan larutan HCl 0,001 M. Tentukan nilai Ka dari HB
PEMBAHASAN :
Jika menghasilkan warna yang sama maka pH kedua larutan sama, artinya [H+] nya sama
Soal No.28
Suatu larutan jika ditetesi indikator metil merah berwarna jingga, jika di tetesi indikator metil jingga berwarna kuning. Berdasarkan tabel berikut perkirakan rentang pHnya
Warna apa yang akan terlihat jika larutan tersebut ditambahkan BTB?
PEMBAHASAN :
Dengan penambahan Metil merah = Jingga artinya pHnya diantara 4,4 – 6,2 (perpaduan warna)
Dengan penambahan metil jingga = kuning, artinya pHnya > 4,4
Jika dibuat diagramnya
pH berada pada rentang : 4,4 < pH < 6,2
Jika ditambah BTB maka akan ada dua kemungkinan:
Jika pHnya < 6 maka berwarna kuning
Jika pHnya 6 < pH < 6,2 maka warnanya akan hijau
Soal No.29
Indikator klorofenol merah memiliki trayek pH 4,8 – 6,4 dengan perubahan warna kuning-merah. Bagaimana perubahan warna jika ditetesi:
a. CH3COOH 0,1 M (Ka = 10-5)
b. NaOH 0,01 M
c. Air murni
Soal No.30
Diketahui beberapa indikator berikut
- Apa warna larutan CH3COOH 0,1 M ( Ka = 10-5) jika ditetesi ketiga indikator di atas?
- Jika suatu larutan berwarna hijau dengan penambahan BTB. Apa larutan tersebut jika ditambah PP
- Jika suatu larutan ditambah metil jingga berwarna merah, apa warna larutan jika ditetesi bromtimol biru?
Soal No.31
Tentukan pH larutan sebelum dicampur dan sesudah dicampur jika 100 mL larutan H2SO4 0,1 M direaksikan dengan 100 mL larutan KOH 0,1 M
PEMBAHASAN :
pH sebelum dicampur
pH H2SO4 (asam kuat)
[H+] = a. Ma = 2 . 10-1 M
pH = 1 – log 2
pH KOH (basa kuat)
[OH—] = b. Mb = 1 . 10-1 M
pOH = 1, pH = 14 – 1 = 13
PH sesudah dicampur
n H2SO4 = M x V = 0,1M x 100 ml = 10 mmol
n KOH = M x V = 0,1M x 100 ml = 10 mmol
Soal No.32
100 mL larutan asam yang mempunyai pH = 1 dicampur dengan 50 mL larutan basa yang mempunyai pH = 13 hitung pH larutan yang terjadi
PEMBAHASAN :
[H+] dari larutan dengan pH = 1 yaitu 10-1 M
[OH—] dari larutan dengan pH = 13 atau pOH = 14 -13 = 1 yaitu 10-1 M
Reaksikan H+ dengan OH—
nH+ = M x V = 10-1 x 100 ml = 10 mmol
nOH— = M x V = 10-1 x 50 ml = 5 mmol
Soal No.33
Berapakah volume larutan NaOH 1 M yang diperlukan untuk menetralkan 50 mL larutan H2SO4 0,5 M?
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma. Va = b. Mb. Vb
2.0,5M. 50 ml = 1. 1 M. Vb
Vb = 50 ml
Soal No.34
Berapakah konsentrasi 5 mL HCl yang dapat dinetralkan oleh 20 mL larutan Ba(OH)2 0,001 M?
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va = b. Mb.Vb
1. Ma. 5 mL = 2 . 0,001 M. 20 mL
Ma = 0,04/5 = 0,008 M
Soal No.35
Tentukan gram Ca(OH)2 yang diperlukan untuk menetralkan 10 mL larutan HNO3 0,05 M, jika diketahui Ar Ca = 40, O = 16, dan H = 1?
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va = b.Mb. Vb
1.0,05 M. 10 mL = 2. Mol basa
Mol b = 0,25 mmol
Gr = mol x Mr = 0,25 mmol x 74 = 18,5 mgram = 0,0185 gram
Soal No.36 (Contoh Soal pH)
Tentukan pH larutan jika 100 mL larutan HCl 0,1 M direaksikan dengan 99,9 mL larutan NaOH 0,1 M (anggap volume campuran = 200 mL)
Soal No.37
Campuran NaOH dan KOH padat yang massanya 4,8 gram dapat menetralkan 100 mL larutan HCl 1 M. Berapa gram massa NaOH dan KOH dalam campuran tersebut?
PEMBAHASAN :
Soal No.38
Tentukan konsentrasi NaOH 50 mL yang dapat dinetralkan oleh larutan H2SO4 0,1 M sebanyak 10 mL
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va =b.Mb.Vb
2.0,1 M. 10 mL = 1. Mb. 50 mL
Mb = 2/50 = 0,04 M
Soal No.39
Berapa volume (dalam cm3) NaOH 0,1 M yang diperlukan untuk menetralkan 25 cm3 larutan H2SO4 0,3 M?
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va =b.Mb.Vb
2. 0,3 M. 25 cm3 = 1. 0,1 M. Vb
Vb = 15/0,1 = 150 cm3
Soal No.40
Magnesium hidroksida (Mg(OH)2) dikenal sebagai bubur magnesia yang dapat dibentuk dari reaksi antara larutan natrium hidroksida dengan larutan magnesium klorida. Berapa cm3 larutan natrium hidroksida 0,3 M yang diperlukan agar tepat habis bereaksi dengan 75 cm3 larutan magnesium klorida 0,2 M? Berapa gram magnesium hidroksida maksimum yang dapat dihasilkan? (Ar Mg = 24, O = 16, dan H = 1)
PEMBAHASAN :
Reaksi yang terjadi:
Mol NaOH = M x V = 0,3 M . x cm3 = 0,3x mmol
Mol MgCl2 = M x V = 0,2 M . 75 cm3 = 15 mmol
Agar tepat habis bereaksi maka NaOH & MgCl2 harus habis
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
Mula2 0,3 x 15 – –
Reaksi 0,3x 0,15x – 0,15x 0,3x +
Sisa – 15 – 0,15x 0,15x 0,3x
15 – 0,15x = 0 (habis bereaksi)
15 = 0,15x
x =15/0,15 =100 cm3 (volume NaOH)
Menentukan gram Mg(OH)2
n Mg(OH)2 = 0,15x = 0,15.100 = 15 mmol = 0,015 mol
Gr = n x Mr = 0,015 mol x 58 = 0,87 gram
Soal No.41
Untuk menentukan kemolaran larutan NaOH, dilakukan titrasi dengan larutan asam klorida 0,1 M sebanyak 25 mL. Ternyata NaOH tersebut tepat memerahkan warna indikator PP pada saat volumenya 29 mL. Tentukan konsentrasi NaOH tersebut.
PEMBAHASAN
Menggunakan rumus titrasi
a.Ma.Va = b.Mb.Vb
0,1 M. 25 mL = 1. Mb. 29 mL
Mb = 2,5/ 29 = 0,086 M
Soal No.42
Suatu contoh cuplikan yang mengandung logam besi bermassa 2 gram direaksikan dengan 100 mL larutan asam klorida 0,100 M. Kelebihan asam klorida dititrasi dengan KOH 0,125 M dan menghabiskan KOH sebanyak 32 mL. Tentukan kadar besi dalam cuplikan tersebut jika Ar Fe = 56 dan reaksi yang terjadi
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Soal No.43
Larutan asam cuka (CH3COOH) sebanyak 25 cm3 dititrasi dengan larutan NaOH 0,100 M, ternyata menghabiskan NaOH sebanyak 30 cm3. Hitunglah kemolaram asam cuka tersebut
Soal No.44
Untuk menentukan kadar asam cuka makan, diambil 10 mL larutan cuka makan kemudian diencerkan sampai volumenya 50 mL. Dari larutan yang telah diencerkan tersebut, diambil 5 mL kemudian dititrasi dengan larutan NaOH 0,100 M, dan menghabiskan 20 mL. Jika kadar cuka murni 17,4 M; tentukan berapa persen kadar cuka makan tersebut.
Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
Soal No.45
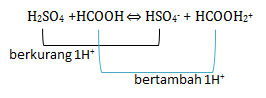
Tentukan pasangan asam basa konjugasi dari berikut
H2SO4 + HCOOH ⇔ HSO4— + HCOOH2+
PEMBAHASAN :
Pasangan asam- basa konjugasi adalah teori yang di cetuskan oleh Bronsted-Lowry. Dimana asam adalah zat yang memberikan/donor proton(H+) sehingga di akhir akan berkurang 1 H+. Sedangkan basa adalah penerima/akseptor proton(H+) sehingga di akhir akan bertambah 1H+. Jika dilihat dari reaksinya:
H2SO4 berkurang 1H+ menjadi HSO4— sehingga H2SO4 bersifat asam sedangkan HSO4— akan bersifat basa atau menjadi basa konjugasi
HCOOH bertambah 1H+ menjadi HCOOH2+ sehingga HCOOH bersifat basa sedangkan HCOOH2+ akan bersifat asam atau menjadi asam konjugasi
Maka pasangan asam-basa konjugasinya adalah H2SO4 – HSO4—
Soal No.46
Jika 9,8 H2SO4 (Ar H = 1, S = 32, O = 16) dilarutkan ke dalam air sampai volumenya 250 mL, maka pH larutan tersebut adalah…
PEMBAHASAN :
Mr H2SO4 = (1 x 2 + 32 x 1 + 16 x 4) = 98
Menentukan molaritas H2SO4![]()
Menentukan pH
Karena H2SO4 merupakan asam kuat maka rumusannya:
[H+] = a. Ma = 2. 0,4 M = 0,8 M = 8 x 10-1 M
pH = – log[H+] = – log 8 x 10-1 M = 1 – log 8
Soal No.47
Larutan NH4OH memiliki molaritas 0,05 M, jika diketahui Kb NH4OH = 2 x 10-5 maka derajat ionisasi NH4OH adalah….
PEMBAHASAN :
NH4OH merupakan basa lemah sehingga terionisasi sebagian. Untuk menentukan derajat ionisasinya menggunakan rumusan:
Soal No.48
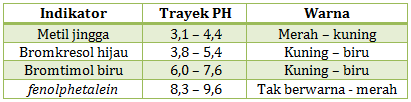
Diketahui trayek perubahan warna indikator sebagai berikut:
Hasil analisis sampel air sebagai berikut:
- terhadap indikator metil jingga memberi warna kuning
- terhadap indikator bromkresol hijau memberi warna biru
- terhadap indikator bromtimol biru memberi warna biru
- terhadap indikator fenolphtalein tidak memberi warna.
Perkiraan pH sampel air tersebut adalah….
PEMBAHASAN :
Dalam mengerjakan soal ini cukup melihat posisi warna yang diperlihatkan dengan pH nya. Jika warna yang diperlihatkan berada di kanan, maka pHnya di atas angka yang kanan. Jika warna yang diperlihatkan di kiri maka pHnya di bawah angka yang kiri. Jika warnanya perpaduan warna kiri kanan. maka PH nya berada di rentan angka kiri kanan.
- sampel air dengan metil jingga memberi warna kuning artinya pH di atas 4,4
- sampel air dengan bromkresol hijau memberi warna biru artinya pH di atas 5,4
- sampel air dengan bromtimol biru memberi warna biru artinya pH di atas 7,6
- sampel air dengan metil fenolphtalein tidak memberi warna artinya pH di bawah 8,3
Jika lebih darinya ada lebih dari satu ambil angka yang terbesar. Dari data tersebut lebih darinya ada 3 yaitu diatas 4.4, di atas 5.4, di atas 7.6. Sehingga diambil diatas 7.6 dan di bawah 8.3. jika dituliskan menjadi
7.6 < pH < 8.3
Soal No.49
Cuplikan yang mengandung K2O (Mr =94) bermassa 18,8 gram dilarutkan ke dalam air hingga volumenya 1 liter. Jika 25 mL larutan tersebut dapat dinetralkan oleh 30 mL larutan H2SO4 0,1 M, kadar K2O di dalam cuplikan tersebut adalah….
PEMBAHASAN :
K2O merupakan oksida basa. Jika direaksikan dengan air maka akan menghasilkan larutan basa KOH.
K2O + H2O → 2KOH
Dalam netralisasi berlaku
mol H+ = mol OH+
a.Ma.Va = b.Mb.Vb (a = valensi asam/jumlah H+, b = valensi basa/jumlah OH—)
2. 0,1 M. 30 ml = 1. Mb. 25 ml![]()
n KOH = M x V = 0,24 x 1 L = 0,24 mol
n K2O = 1/2 x 0,24 mol = 0,12 (dihitung lewat perbandingan dengan koefisien)
Gr K2O = n x Mr = 0,12 x 94 = 11,28 gr
Maka kadarnya:![]()
Soal No.50
Campuran dari 100 mL larutan HBr 0,1 M dengan 100 mL larutan H2SO4 0,1 M maka volume KOH 0,2 M yang dapat menetralkan campuran tersebut adalah….
PEMBAHASAN :
Dalam reaksi penetralan berlaku:
mol H+ = mol OH—
Karena H+ berasal dari dua zat asam yaitu HBr dan H2SO4 maka perlu dicari mol H+ total![]()
![]()
Dalam menentukan mol H+ dari H2SO4 dikali 2 karena valensi asamnya/jumlah H+ nya = 2
maka volume basanya
mol H+ = mol OH—
30 mmol = b.Mb.Vb
30 =1. 0,2 M. Vb![]()
Soal No.51
Basa M(OH)2 memiliki massa 3,16 gram dilarutkan ke dalam air. Larutan tersebut dapat dinetralkan oleh 100 mL larutan HBr 0,4 M. Tentukan massa atom relatif unsur M tersebut.
PEMBAHASAN :
Dalam netralisasi berlaku:
mol H+ = mol OH—
a.Ma.Va = b.Mb.Vb
1. 0,4 M. 100 = 2. n ( n = Mb. Vb)
n = 20 mmol = 2 x 10-2 mol
Menentukan Mr menggunakan rumusan![]()
![]()
Menentukan Ar M
Mr M(OH)2 = Ar M x 1 + Ar O x 1 + Ar H x 2
158 = Ar M + 16 + 1 x 2
Ar M = 158 – 18 = 140
Soal No.52
Tentukan asam konjugasi dari HCO3—
PEMBAHASAN :
Menentukan asam konjugasi berarti HCO3— nya sendiri bersifat basa. Pertanyaan ini berdasarkan teori asam basa Bronsted-Lowry. Basa menurut Bronsted-Lowry merupakan penerima proton (H+) sehingga untuk menentukan asam konjugasinya maka basa perlu ditambah 1H+. Sehingga Asam konjugasi dari HCO3— adalah H2CO3
Soal No.53
Tentukan pH 5,6 gram CaO (Ar Ca = 40, O = 16) yang bereaksi dengan 1 L HCl 0,1 M
PEMBAHASAN :
CaO merupakan oksida basa yang jika direaksikan dengan air akan menghasilkan basanya
CaO + H2O → Ca(OH)2
Menentukan mol masing-masing![]()
n Ca(OH)2 akan sama dengan nCaO karena koefisiennya sama
nCa(OH)2 = 0,1 mol
Mereaksikan Ca(OH)2 dengan HCl
mol HCl = 0,1 M x 1 l = 0,1 mol
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
mula2 0,1 0,1 — –
reaksi 0,05 0,1 — 0,05 0,1 +
sisa 0,05 – 0,05 0,1
Karena yang bersisa adalah Ca(OH)2 maka pH campuran akan bersifat basa, karena termasuk basa kuat maka rumusannya![]()
[OH—] = b.Mb = 2. 0,05 M = 0,1 M = 10-1 M
pOH = 1
pH = 14 – 1 = 13
Soal No.54
Larutan NaOH memiliki pH = 12. Jika massa molar NaOH = 40 gram/mol, tentukan massa NaOH yang dilarutkan ke dalam 4 liter larutan tersebut
PEMBAHASAN :
Karena NaOH merupakan basa maka pH kita ubah ke pOH
pOH = 14 – pH = 14 – 12 = 2
[OH-] = 10-2
Karena basa kuat maka rumusannya
[OH-] = b. Mb![]()
![]()
Gr = 160 x 10-2 = 1,6 gram
Soal No.55
Sebanyak 200 ml larutan KOH 0,01 M diencerkan dengan air hingga volume larutan 2 liter, pH larutan hasil pengenceran adalah….
PEMBAHASAN :
Menentukan Molaritas KOH setelah pengencaran menggunakan rumus pengenceran
M1. V1 = M2. V2
0,01 M . 0,2 L = M2 . 2 L![]()
Maka pH setelah pengenceran adalah
[OH—] = b. Mb = 1 x 10-3 M = 10-3 M
pOH = 3
pH = 14 – pOH = 14 – 3 = 11
Soal No.56
Suatu asam lemah HA dengan konsentrasi 0,1 M terionisasi sebanyak 1%. Tetapan kesetimbangan asam lemah tersebut adalah….
PEMBAHASAN :
Menentukan Ka dapat menggunakan rumus:![]()
Ka = α2 . M
Ka = (1%)2 . 0,1 M = (0,01)2 . 0,1
Ka = 10-4 . 0,1 = 10-5
Soal No.57
Tentukan konsentrasi larutan apabila 0,01 g padatan NaOH dilarutkan sebanyak 25 ml serta tentukan pH dari larutan tersebut! (Mr NaOH = 40)
PEMBAHASAN :
Menentukan molaritas NaOH![]()
Menentukan pH NaOH (basa kuat)
[OH-] = b. Mb = 1 x 10-2 M = 10-2 M
pOH = 2
pH = 14 – pOH = 14 – 2 = 2
Soal No.58
Kedalam 150 ml larutan HCl ditambahkan 1,11 gram Ca(OH)2 (Mr=74 g/mol). pH larutan diperoleh sama dengan 7. konsentrasi larutan HCl sebelumnya adalah … M
PEMBAHASAN :
Diketahui:![]()
n HCl = M x V = M x 150 ml = 150M mmol = 150 x 10-3 M mol = 0,15M mol
pH = 7 tercapai jika HCl (asam kuat) dan Ca(OH)2 (basa kuat) habis bereaksi
Maka nilai M adalah
0,015 – 0,075M = 0
0,015 = 0,075M![]()
Informasi soal nomor 59 s.d 61
Sebanyak 25 ml larutan metilamina (CH3NH2) 0,04 M (Kb = 4 x 10-4) dititrasi dengan larutan HCl 0,02 M
Soal No.59 (UTBK 2019)
pH larutan CH3NH2 sebelum dititrasi adalah….
- 3 – 2 log 2
- 5 – 2 log 4
- 9 + 2 log 4
- 10 + 2 log 2
- 11 + 2 log 2
Soal No.60 (UTBK 2019)
pH larutan setelah dititrasi dengan 25 ml HCl adalah…
- 6 – log 2
- 6 + log 2
- 8 – log 2
- 8 + log 2
- 10 + 2 log 2
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 25 ml = 0,5 mmol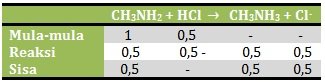
Karena yang bersisa adalah basa lemah dan asam konjugasinya maka akan membentuk larutan penyangga basa, yang pH nya![]()
pOH = 4 – log 4
pH = 10 + log 4 = 10 + 2 log 2
Jawaban E
Soal No.61 (UTBK 2019)
Setelah penambahan 55 ml HCl, campuran diencerkan dengan air sampai 100 ml. Berapakah pH nya?…
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 55 ml = 1,1 mmol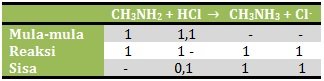
Karena yang bersisa adalah asam kuat maka pH dihitung dengan rumus asam kuat![]()
[H+] = a. Ma = 1. 0,00125 M = 0,00125 M
Kemudian larutan diencerkan sampai 100 ml
M1. V1 = M2. V2
0,00125M. 80 ml = M2. 100 ml![]()
maka pH = 3
Jawaban B
Informasi soal nomor 62 s.d 63
Fenol, C6H5OH merupakan asam lemah dengan Ka = 10-10. Sebanyak 30 ml larutan fenol 0,1 M dititrasi dengan larutan NaOH 0,1 M, nilai pH dalam labu titrasi dimonitor dengan pH meter. Setelah penambahan 15 mL NaOH, campuran larutan dalam labu titrasi diencerkan dengan H2O murni hingga volume 100 mL
Soal No.62 (UTBK 2019)
pH larutan fenol sebelum titrasi adalah….
- 1
- 2,5
- 4
- 5,5
- 10,0
PEMBAHASAN :
fenol C6H5OH merupakan asam lemah, maka pH nya dihitung menggunakan rumus asam lemah![]()
pH = 5,5
Jawaban D
Soal No.63 (UTBK 2019)
Setelah penambahan 10 mL larutan NaOH, konsentrasi natrium fenolat dalam larutan pada labu titrasi menjadi….
- 0,001
- 0,025
- 0,040
- 0,050
- 0,10
PEMBAHASAN :
n C6H5OH = M x V = 0,1 M x 30 ml = 3 mmol
n NaOH = M x V = 0,1 M x 10 ml = 1 mmol
Jika dituliskan dalam reaksi: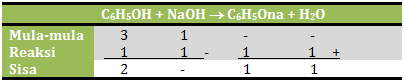
Maka konsentrasi natrium fenolat adalah![]()
Jawaban B
Soal No.64 (UTBK 2019)
Logam Na, Ca, Mg, Zn dan Ag dimasukkan ke dalam larutan HCl pekat kemudian ditambahkan padatan KOH. Logam yang lebih dulu mengendap adalah…
PEMBAHASAN :
Pertama kali logam akan bereaksi dengan HCl. Golongan IA dan IIA dan juga Zn akan larut sedangkan logam Ag jika direaksikan dengan HCl akan membentuk AgCl yang akan pertama kali mengendap namun ketika direaksikan dengan KOH maka kelarutan yang paling rendah dialami oleh Zn(OH)2
Jawaban E
Soal No.65 (UTBK 2018)
Berdasarkan reaksi berikut:
yang BUKAN merupakan pasangan asam-basa konjugasi adalah….
- CH3OH dan CH3O—
- HC2H3O2 dan HCO3—
- C6H5NH2 dan C6H5NH3—
- C2H3O2— dan HC2H3O2
- HCO3— dan CO32-
PEMBAHASAN :
Asam Basa menurut Bronsted-Lowry
Asam : Pemberi/donor proton (H+) → berkurang di akhir 1 H+
Basa : Penerima/akseptor proton (H+) → bertambah di akhir 1 H+
Perubahan dari asam menjadi basa konjugasi yaitu akan mengalami pengurangan sebanyak 1 H+
- CH3OH dan CH3O— : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HC2H3O2 dan HCO3— : : Bukan merupakan pasangan asam-basa konjugasi karena jumlah H nya tidak memiliki selisih 1 H+ dan jumlah atom lainnya berbeda
- C6H5NH2 dan C6H5NH3+ : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- C2H3O2— dan HC2H3O2 : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HCO3— dan CO32- : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
Jawaban yang tepat adalah B
Jawaban B
Soal No.66 (SBMPTN 2016)
Suatu reaksi berlangsung sebagai berikut:
Pernyataan yang BENAR terkait reaksi tersebut adalah….
- CO32- bertindak sebagai asam Bronsted-Lowry
- SO42- bertindak sebagai asam Lewis
- CO2 bertindak sebagai asam Bronsted-Lowry
- CO2 bertindak sebagai basa Lewis
- SO3 bertindak sebagai asam lewis
PEMBAHASAN :
Pada reaksi:
CO32- + SO3![]() SO42- + CO2
SO42- + CO2
Tidak terdapat atom H yang bisa di serah terima kan pada teori Bronsted-Lowry
maka reaksi ini dijelaskan melalui teori Asam Basa Lewis
Basa Lewis merupakan donor/pemberi pasangan elektron, cirinya memiliki PEB atau bermuatan negatif. Pada reaksi tersebut yang berperan memberikan pasangan elektron adalah CO32- karena memiliki kelebihan elektron untuk diberikan, sedangkan yang berperan sebagai asam lewis atau penerima pasangan elektron adalah SO3
Jawaban E
Soal No.67 (SBMPTN 2015)
Asam oksalat adalah asam berbasa dua. Sebanyak 10 mL larutan asam oksalat diencerkan dengan air sampai volumenya 100 mL. Larutan ini digunakan untuk menitrasi 20 mL larutan NaOH 0,2 M dengan indikator bromtimol biru. Bila titik akhir titrasi diperoleh saat volume asam oksalat mencapai 25 mL, maka konsentrasi larutan asam oksalat awal adalah….
- 0,08 M
- 0,40 M
- 0,80 M
- 1,60 M
- 3,20 M
PEMBAHASAN :
Untuk menentukan konsentrasi asam oksalat awal kita menentukan terlebih dahulu konsentrasi asam oksalat yang digunakan untuk menitrasi NaOH. Rumusan untuk titrasi dapat menggunakan
Diketahui:
a (valensi asam/jumlah atom H dalam asam oksalat) = 2
Va (volume asam oksalat yang digunakan untuk titrasi) = 25 mL
b (valensi basa/ jumlah OH dalam NaOH) = 1
Mb = Molaritas basa/NaOH = 0,2 M
Vb (volume NaOH yang digunakan untuk titrasi) = 20 mL
a. Ma. Va = b. Mb. Vb
2. Ma. 25 = 1. 0,2. 20
Ma = 4/50 = 0,08 M
Kemudian kita menentukan molaritas awal menggunakan rumusan pengenceran dengan volume akhir 100 mL yang diambil 25 mL untuk titrasi
M1.V1 = M2.V2
M1 . 10 mL = 0,08 M. 100 mL
M1 = 8/10 = 0,8 M
maka molaritas mula-mulanya adalah 0,8 M
Jawaban D
Soal No.68 (SBMPTN 2014)
Proses Haber-Bosch merupakan proses pembentukan (produksi) amonia berdasarkan reaksi:
Data Kp dan Kc dari reaksi kesetimbangan tersebut pada berbagai temperatur adalah
Dalam wadah 1 L terdapat 20 g H2, 28 g N2 dan sejumlah NH3 dalam kesetimbangan pada 300 oC. Jika gas NH3 dalam kesetimbangan tersebut dipisahkan dan dilarutkan dalam 1 L air, maka pH larutan yang diperoleh adalah….(Kb NH4OH = 10-5)
PEMBAHASAN :
Reaksi yang terjadi
3H2 + N2![]() 2NH3
2NH3
menentukan [H2] dan [N2]
Menentukan [NH3] dari data Kc pada suhu 300 oC![]()
![]()
[NH3]2 = 10-5. 103 = 10-2
[NH3] = 10-1
Karena dilarutkan ke dalam air sehingga membentuk NH4OH yang merupakan basa lemah, maka pH nya![]()
pOH = 3
pH = 14 – 3 = 11
Jawaban D
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Gimana belajar asam basa nya, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Ok demikian rangkuman materi dan contoh soal asam basa & titrasi berikut video pembelajaran dan latihan soalnya. Kumpulan pertanyaan tentang asam dan basa berikut pembahasan asam basa semoga berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.
Semoga Bermanfaat