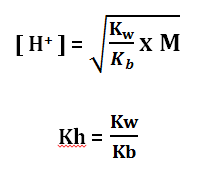Untuk Pembelajaran selanjutnya…
Lanjut lagi kita akan belajar bab hidrolisis. Di bab asam basa kita mengenal ada yang namanya garam yaitu hasil reaksi antara asam dan basa. Nah, di bab ini kita akan menghitung pH masing-masing garam. Jadi kita bantu buatkan rangkuman materi dan contoh soal hidrolisis buat kamu kelas 11. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini dan terakhir coba latihan soal hidrolisis yah. Selamat belajar
Hidrolisis adalah penguraian/pemecahan oleh air. komponen garam baik kation maupun anion yang berasal dari asam lemah atau basa lemah akan bereaksi dengan air/terhidrolisis. Sedangkan kation dan anion garam yang berasal dari asam kuat dan basa kuat tidak dapat bereaksi dengan air.
Jenis-jenis Garam berdasarkan asam basa penyusunnya:
Garam dari asam kuat dan basa kuat. (Tidak terhidrolisis)
Garam ini tidak akan bereaksi dengan air. Hal ini disebabkan kation dan anionnya berasal dari asam kuat dan basa kuat. kation dan anion yang berasal dari asam kuat dan basa kuat akan memiliki sifat berkebalikan menjadi basa lemah dan asam lemah. Nilai pH larutan garamnya = 7 (netral). Garam ini disebut tidak terhidrolisis.
Contoh:
Reaksi Hidrolisis NaCl
NaCl ® Na+ (aq) + Cl−
Na+ (aq) + H2O(l) ® (tidak bereaksi)
Cl− (aq)+ H2O(l) ® (tidak bereaksi)
Contoh Soal:
Tentukan pH dari 10ml larutan NaCl 2 M
Jawaban:
pH = 7 (netral), karena garamnya berasal dari asam kuat dan basa kuat
Garam dari asam kuat dan basa lemah. (Hidrolisis sebagian/parsial)
Contoh :
NH4Cl (berasal dari NH4OH dan HCl), Al2(SO4)3 (berasal dari Al(OH)3 dan H2SO4)
Garam ini akan terhidrolisis sebagian/parsial yaitu hanya ion positif (kation) yang
berasal dari basa lemah yang bereaksi dengan air.
Contoh:
Reaksi Hidrolisis dari NH4Cl
NH4+ + H2O → NH4OH + H+
Cl− + H2O ® (tidak bereaksi)
Karena menghasilkan ion H+ maka garam ini akan bersifat asam, jumlah [H+] dapat dihitung melalui rumus:
Perhitungan pH
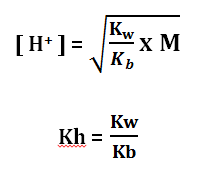
pH = – log [H+]
Keterangan:
Kw = Tetapan Ionisasi Air = 10-14
Kb = tetapan ionisasi basa lemah
M = Molaritas Kation
Kh = Tetapan hidrolisis
Tipe soal I: Jika diketahui di soal hanya garam maka langsung masuk rumus.
Contoh Soal:
Tentukan pH dari larutan (NH4)2SO4 0,05 M (Kb NH3 = 10-5)
Jawaban:
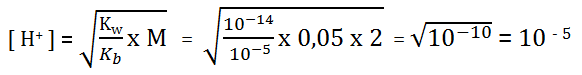
Jumlah kationnya (NH4+) berjumlah 2 maka konsentrasi dikali 2
pH = 5
Tipe soal II:
Jika diketahui di soal asam dan basanya. Maka harus direaksikan dengan metode m, r , s
Contoh Soal:
Larutan 1L NH4OH 2 M bereaksi dengan 1 L H2SO4 1 M tentukan pH campuran!
Jawaban:
Reaksi :
. 2NH4OH(aq) + H2SO4(aq) → (NH4)2SO4 + 2H2O
Mula2 2 mol 1 mol − −
Reaksi 2 1 − 1 2 +
Sisa − − 1 mol 2 mol
Ciri Hidrolisis:
Asam dan Basa akan habis
Menentukan M garam
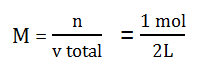
Masuk Rumus :

pH = 4,5
Garam dari asam lemah dan basa kuat. (Hidrolisis sebagian/parsial)
Contoh : CH3COONa (berasal dari CH3COOH) dan NaOH), KCN (berasal dari KOH dan HCN)
Garam ini akan terhidrolisis sebagian karena hanya salah satu ion yang bereaksi dengan air yaitu ion negatif (anion) yang berasal dari asam lemah.
Contoh Reaksi Hidrolisis CH3COONa adalah
CH3COO− + H2O → CH3COOH + OH−
Na+ + H2O ® (Tidak bereaksi)
Karena menghasilkan ion OH− maka garam ini akan bersifat basa
Perhitungan pH
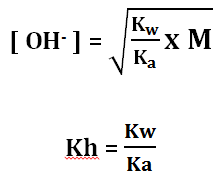
pOH = – log [OH−]
pH = 14 – pOH
Keterangan:
Kw = tetapan kesetimbangan air = 10-14
Ka = tetapan ionisasi asam lemah
M = Molaritas anion
Tipe soal I: Jika diketahui di soal hanya garam maka langsung masuk rumus.
Contoh Soal:
Tentukan pH dari larutan CH3COONa 0,1 M (Ka CH3COOH = 10-5)
Jawaban:
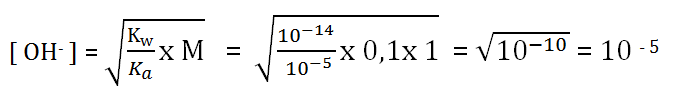
Jumlah anionnya (CH3COO−) berjumlah 1 maka konsentrasi dikali 1
pOH = 5
pH = 14 – 5 = 9
Tipe soal II:
Jika diketahui di soal asam dan basa. Maka harus direaksikan dengan metode m, r , s
Contoh Soal:
Larutan 0,5L KOH 2M bereaksi dengan 0,5 L HCN 2M tentukan pH campuran!
Jawaban:
Reaksi :
KOH(aq) + HCN(aq) → KCN + H2O
Mula2 1 mol 1 mol − −
Reaksi 1 1 − 1 1 +
Sisa − − 1 mol 1 mol
Ciri Hidrolisis
Asam dan Basa akan habis
Menentukan M garam
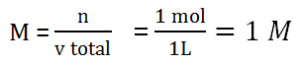
Masuk Rumus :

pOH = 4,5
pH = 14 – 4,5 = 9,5
Garam dari asam lemah dan basa lemah. (Hidrolisis sempurna)
Contoh : NH4CN (berasal dari NH4OH dan HCN)
Garam ini akan terhidrolisis sempurna yaitu ion positif (kation) yang berasal dari basa
lemah.dan ion negatif (anion) yang berasal dari asam lemah.
Contoh reaksi hidrolisis NH4CN adalah
NH4+ + H2O → NH4OH + H+
CN− + H2O → HCN + OH−
Sifat asam dan basa ditentukan oleh besarnya Ka dan Kb, Jika:
Ka > Kb garam akan bersifat asam
Ka < Kb garam akan bersifat basa
Ka = Kb garam akan bersifat netral
Perhitungan pH
Jika Ka > Kb (garam asam) Rumusnya:
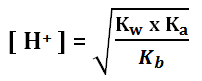
Jika Ka < Kb (garam basa) Rumusnya:

Keterangan:
Kw = tetapan kesetimbangan air = 10-14
Kb = tetapan ionisasi basa lemah
Ka = tetapan ionisasi asam lemah
Contoh Soal:
Tentukan pH dari larutan NH4CN 0,05 M (Kb NH3 = 10-5, Ka HCN = 10-8)
Jawaban:
Ka < Kb maka akan bersifat basa
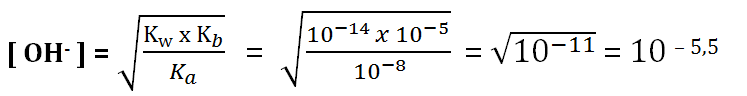
pOH = 5,5
pH = 14 – 5,5 = 8,5
Soal No.1
Jelaskan apa yang dimaksud dengan hidrolisis garam?
PEMBAHASAN :
Reaksi antara ion garam dengan air.
Soal No.2
Apa yang dimaksud dengan hidrolisis parsial? Berikan contohnya
PEMBAHASAN :
Hidrolisis parsial yaitu bereaksinya sebagian ion dari garam dengan air. Contohnya pada garam yang terbentuk dari Asam lemah dan basa kuat CH3COONa. Yang bereaksi dengan air hanya ion CH3COO—, ion Na+ tidak bereaksi dengan air
Soal No.3
Apakah semua garam dapat mengalami hidrolisis? Jelaskan dan berikan contohnya.
PEMBAHASAN :
Tidak semua garam dapat mengalami hidrolisis. Beberapa jenis garam diantaranya:
- Garam dari asam kuat dan basa kuat, contoh : NaCl tidak mengalami hidrolisis
- Garam dari asam lemah dan basa kuat atau dari asam kuat dan basa lemah mengalami hidrolisis parsial/sebagian, contohnya: KCN atau AgCl
- Garam dari asam lemah dan basa lemah, mengalami hidrolisis sempurna/total, contohnya : CH3COOCN
Soal No.4
Lakukan analisis apakah larutan garam berikut ini mengalami hidrolisis. Jika mengalami hidrolisis, tuliskan reaksi hidrolisisnya.
a. Pb(NO3)2
b. (NH4)2CO3
c. KNO3
d. MgSO4
e. Na2HPO4
PEMBAHASAN :
Hanya ion yang berasal dari asam lemah atau yang berasal dari basa lemah yang dapat bereaksi dengan air. Sedangkan ion dari asam kuat atau basa kuat tidak bereaksi dengan air
a. Pb(NO3)2 → Pb2+ + 2NO3—
Pb2+ + 2H2O → Pb(OH)2 + 2H+
2NO3— + H2O → tidak bereaksi (terhidrolisis parsial/sebagian)
b. (NH4)2CO3 → 2NH4+ + CO32-
NH4+ + H2O → NH4OH + H+
CO32- + 2H2O → H2CO3 + 2OH— (terhidrolisis sempurna/total)
c. KNO3 → K+ + NO3—
K+ + H2O → tidak bereaksi
NO3— + H2O → tidak bereaksi (tidak terhidrolisis)
d. MgSO4 → Mg2+ + SO42-
Mg2+ + 2H2O → Mg(OH)2 + 2H+
SO42- + H2O → tidak bereaksi (terhidrolisis sebagian/parsial)
e. Na2HPO4→ 2Na+ + HPO42-
Na+ + H2O → tidak bereaksi
HPO42- + H2O → H2PO4— + OH— (terhidrolisis sebagian/parsial)
Pembahasan Dalam Bentuk Video:
Soal No.5
Bagaimana warna kertas lakmus merah dan kertas lakmus biru jika dimasukkan ke dalam larutan berikut? Berilah penjelasan
- AlCl3
- CuSO4
- Ba(NO3)2
- KCN
- Na2CO3
PEMBAHASAN :
Untuk menentukan sifat asam atau basa suatu garam, bisa menentukan langsung dari asam atau basa penyusunnya. Sifat garam akan mengikuti asal yang bersifat kuat. Jika yang kuat asam maka garam akan bersifat asam, jika yang kuat basa maka yang garam bersifat basa. Jika keduanya kuat akan bersifat netral. Jika keduanya lemah, maka akan bergantung pada nilai Ka dan Kb
- AlCl3 bersifat asam karena berasal dari asam kuat HCl dan basa lemah Al(OH)3, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna merah
- CuSO4 bersifat asam karena berasal dari asam kuat H2SO4 dan basa lemah Cu(OH)2, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna merah
- Ba(NO3)2 bersifat netral karena berasal dari asam kuat HNO3 dan basa kuat Ba (OH)2, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna biru
- KCN bersifat basa karena berasal dari asam lemah HCN dan basa kuat KOH, jika dimasukan lakmus merah akan berwarna biru. Jika dimasukan lakmus biru akan berwarna biru
- Na2CO3 bersifat basa karena berasal dari asam lemah H2CO3 dan basa kuat NaOH, jika dimasukan lakmus merah akan berwarna biru. Jika dimasukan lakmus biru akan berwarna biru
Pembahasan Dalam Bentuk Video:
Soal No.6
Hitunglah pH larutan:
- CH3COONa 1 M (Ka CH3COOH = 1 x 10-5)
- NH4Cl 0,1 M (Kb NH4OH = 1 x 10-5)

Pembahasan Dalam Bentuk Video:
Soal No.7
Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur dengan 150 mL larutan NaOH 0,1 M (Ka CH3COOH = 10-5). Berapakah pH campuran tersebut?
PEMBAHASAN :
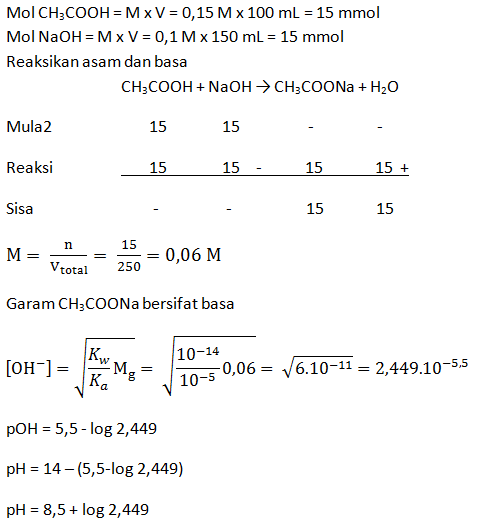
Pembahasan Dalam Bentuk Video:
Soal No.8
Larutan NaX 0,1 M terhidrolisis 10%. Hitunglah tetapan hidrolisis garam tersebut dan pH larutannya.
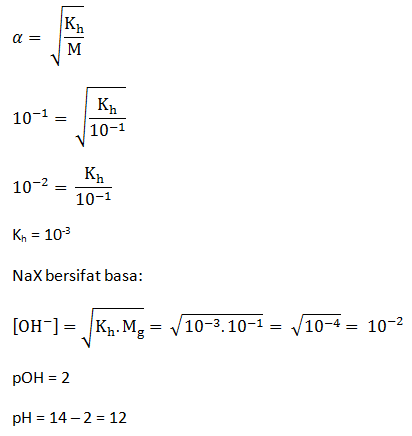
Pembahasan Dalam Bentuk Video:
Soal No.9
Hitunglah pH larutan dari:
- Larutan NaCN 0,1 M (Ka HCN = 4 x 10-6)
- CH3COONH4 0,1 M ( Ka CH3COOH = 1 x 10-5 dan Kb NH3 = 1 x 10-5)
- Campuran 100 mL CH3COOH 0,1 M dengan 100 mL larutan NaOH 0,1 M (Ka = 1 x 10-5)
- Campuran 200 mL NH3 0,3 M dengan 300 mL HCl 0,2 M (Kb = 1 x 10-5)
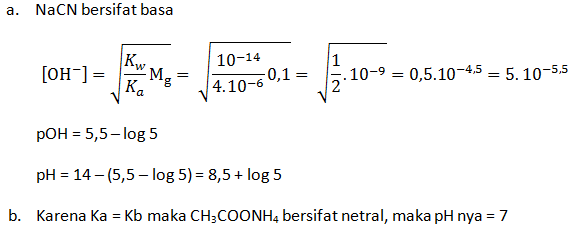
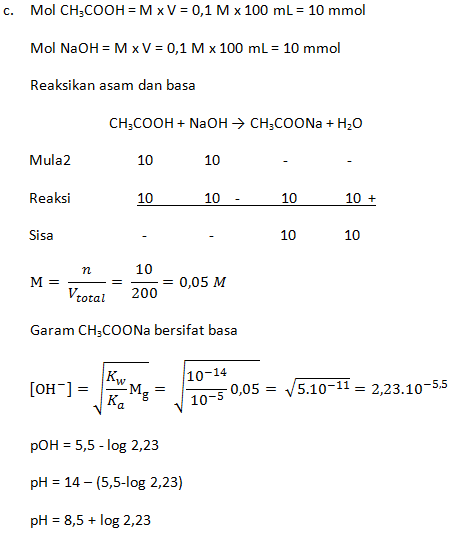
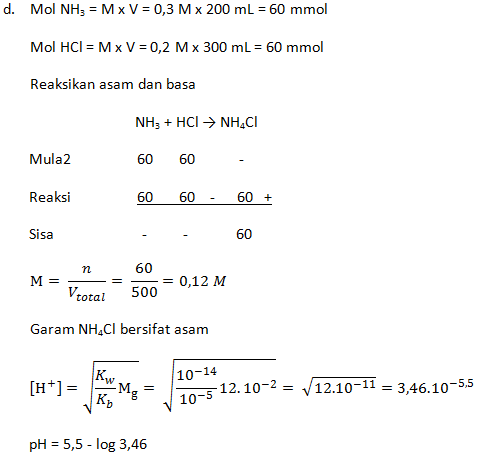
Pembahasan Dalam Bentuk Video:
Soal No.10
Berapa gram NH4Cl yang terlarut dalam 200 mL larutan NH4Cl dengan pH = 4? Diketahui Kb NH3 = 10-5.
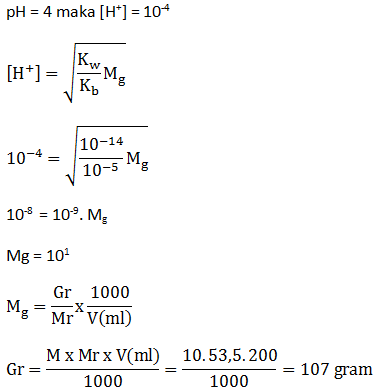
Pembahasan Dalam Bentuk Video:
Sumber Soal : KIMIA Kelas XI Pengarang Unggul Sudarmo, Penerbit Erlangga
Ke dalam 200 mL larutan HCN 0,10 M (Ka = 10-10) ditambahkan 1,12 g KOH (Mr = 56). Larutan yang dihasilkan memiliki pH…
- 9,5
- 10,0
- 11,5
- 12,5
- 13,0
HCN merupakan asam lemah dan KOH merupakan basa kuat. Jika ada asam dan basa maka reaksikan terlebih dahulu.
Menentukan mol HCN
n = M x V = 0,1 M x 200 mL = 0,1 M x 0,2 L= 0,02 mol
Menentukan mol KOH

Karena kedua pereaksi habis maka termasuk hidrolisis yang ditinjau adalah garam. Garam yang di hasilkan dari reaksi HCN dan KOH akan bersifat basa karena terbentuk dari basa kuat dan asam lemah (hidrolisis lihat siapa yang kuat)
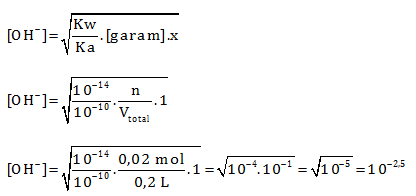
pOH = 2,5
pH = 14 – 2,5 = 11,5
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.12 (SNMPTN 2012)
Jika Kh ClO− pada suhu tertentu adalah 4,0 x 10-7, pH larutan KClO 0,1 M adalah…
- 4 – log 2
- 5 – log 4
- 10 + log 2
- 10 – log 2
- 10 + log 4
KClO merupakan garam yang terbentuk dari KOH(Basa kuat) dan HClO (asam lemah), maka sifat garamnya bisa dilihat dari yang kuat yaitu basa. Maka pH nya dapat ditentukan dengan rumus
pOH = 4 – log 2
pH = 14 – (4 – log 2) = 10 + log 2
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.13 (SNMPTN 2012)
Jika diketahui Kb NH3 adalah 2,0 x 10-5, maka pH larutan NH4Cl 0,008 M adalah…
- 4 – log 2
- 6 + log 4
- 6 – log 2
- 8 + log 2
- 8 – log 4
NH4Cl merupakan garam yang terbentuk dari NH4OH(basa lemah) dan HCl (asam kuat), maka sifat garamnya bisa dilihat dari yang kuat yaitu asam. Maka pH nya dapat ditentukan dengan rumus
[H+] = 2. 10-6
pH = 6 – log 2
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.14 (SNMPTN 2012)
pH larutan yang diperoleh dengan mencampurkan 250 mL larutan ammonia 0,1 M (Kb NH3 = 10-5) 250 mL HCl 0,1 M dan 500 mL air adalah….
- 9 – log 5
- 8 + log 5
- 8 – log 5
- 6 + log 5
- 6 – log 5
PEMBAHASAN :
Menentukan mol NH3 dan HCl sebelum direaksikan
n NH3 = M x V = 0,1 M x 250 mL = 25 mmol (NH3 dan H2O jika direaksikan menjadi NH4OH)
n HCl = M x V = 0,1 M x 250 mL = 25 mmol
Maka jika direaksikan
NH4OH + HCl → NH4Cl + H2O
reaksi 25 25 – 25 25 +
Sisa − – 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.
Maka pH nya dapat ditentukan dengan rumus
[H+] = 5. 10-6
pH = 6 – log 5
Jawaban E
Pembahasan Dalam Bentuk Video:
Soal No.15 (SNMPTN 2010)
Sebanyak 25 mL CH3COOH 0,1 M tepat dititrasi dengan 25 mL NaOH 0,1 M. Jika diketahui Ka CH3COOH = 10-5, pernyataan yang benar tentang reaksi titrasi tersebut adalah….
- pH larutan asam sebelum titrasi adalah 3
- pH larutan asam setelah titrasi lebih besar dari 7
- CH3COONa hasil reaksi mengalami hidrolisis
- Konsentrasi Na+ dalam campuran 0,05 M
PEMBAHASAN :
- pH larutan asam sebelum titrasi adalah 3
CH3COOH merupakan asam lemah, sehingga menentukan pH menggunakan rumusan
pH = 3
BENAR - pH larutan asam setelah titrasi lebih besar dari 7
Karena garam yang dihasilkan CH3COONa terbentuk dari CH3COOH (asam lemah) dan NaOH (basa kuat), sifat garamnya bisa dilihat dari yang kuat yaitu basa atau pH > 7
BENAR - CH3COONa hasil reaksi mengalami hidrolisis
Reaksi CH3COONa dengan air setelah sebelumnya terionisasi
CH3COONa → CH3COO− + Na+
……………………..basa kuat asam lemah (yang bereaksi hanya CH3COO−)
CH3COO− + H2O → CH3COOH + H+
Na+ + H2O → tidak bereaksi
Mengalami hidrolisis parsial/sebagian
BENAR - Konsentrasi Na+ dalam campuran 0,05 M
Menentukan mol CH3COOH dan NaOH sebelum direaksikann NH3 = M x V = 0,1 M x 25 mL = 2,5 mmol
n NaOH = M x V = 0,1 M x 25 mL = 2,5 mmol
Maka jika direaksikanCH3COOH + NaOH → CH3COONa + H2O
mula-mula 2,5 2,5 − –
reaksi 2,5 2,5 – 2,5 2,5 +
Sisa − − 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.
CH3COONa → CH3COO− + Na+
0,05 M 0,05M
BENAR
Jawaban E
Pembahasan Dalam Bentuk Video:
Soal No.16 (SPMB 2006)
Larutan di bawah ini yang dapat mengubah lakmus merah menjadi biru adalah…
- CH3COONa
- CH3COONH4
- Al2(SO4)3
- NH4CN
- Na2SO4
PEMBAHASAN :
Larutan garam yang mengubah lakmus merah menjadi biru adalah garam basa yaitu yang terbentuk dari basa kuat dan asam lemah yaitu pilihan A CH3COONa dari CH3COOH (asam lemah) dan NaOH (basa kuat)
Jawaban A
Pembahasan Dalam Bentuk Video:
Soal No.17 (SPMB 2006)
Garam berikut yang akan mempunyai pH < 7 jika dilarutkan dalam air adalah….
- NH4CN
- CH3COONa
- KNO3
- NH4NO3
PEMBAHASAN :
Larutan garam yang mempunyai pH < 7 adalah garam basa yaitu yang terbentuk dari asam kuat dan basa lemah yaitu pilihan 4 saja NH4NO3 dari NH4OH (basa lemah) dan HNO3 (asam kuat)
Jawaban D
Pembahasan Dalam Bentuk Video:
Soal No.18 (SPMB 2005)
Larutan NaCl terhidrolisis sempurna menjadi NaOH dan HCl
SEBAB
Kesetimbangan ionisasi terjadi pada larutan asam dan basa lemah
PEMBAHASAN :
Larutan NaCl jika terionisasi akan terurai menjadi
NaCl(aq) → Na+(aq) + Cl−(aq)
Sifat Na+ (asam lemah) dan Cl− (basa lemah), sehingga keduanya tidak bereaksi dengan air (tidak terhidrolisis). Pernyataan salah. Kesetimbangan ionisasi hanya terjadi pada asam lemah dan basa lemah sedangkan pada asam kuat dan basa kuat terjadi reaksi searah. Alasan Benar
Jawaban D
Pembahasan Dalam Bentuk Video:
Soal No.19 (SPMB 2003)
Larutan NaCN 0,20 M sebanyak 50 mL diencerkan menjadi 100 mL. Ka HCN = 10-9 Kw = 10-14. Pernyataan yang benar tentang larutan ini adalah….
PEMBAHASAN :
- Konsentrasi larutan NaCN menjadi 0,1 M
Menentukan molaritas setelah pengenceran, menggunakan rumus:
M1.V1 = M2.V2
0,2 M. 50 mL = M2. 100 mL
M2 = 10/100 = 0,1 M
BENAR - Larutan terhidrolisis dengan reaksi
CN− + H2O HCN + OH−
HCN + OH−
NaCN mengalami ionisasi
NaCN → Na+ + CN−
………..asam lemah basa kuat
Na+ + H2O → tidak bereaksi
CN− + H2O → HCN + OH−
BENAR - Konstanta reaksi hidrolisis =

Reaksi hidrolisisnya
CN− + H2O → HCN + OH−
Maka konstanta reaksi hidrolisisnya
Kh =
BENAR - pH larutan = 11
NaCN berasal dari NaOH (basa kuat) dan HCN (asam lemah), maka garamnya bersifat basa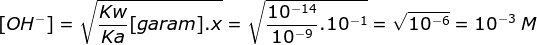
pOH = 3
pH = 14 – 3 = 11
BENAR
Jawaban E
Pembahasan Dalam Bentuk Video:
Soal No.20 (SPMB 2002)
Di antara garam-garam berikut yang bila dilarutkan dalam air mengalami hidrolisis parsial adalah….
- Natrium asetat
- Ammonium asetat
- Ammonium klorida
- Natrium klorida
PEMBAHASAN :
Hidrolisis parsial terjadi pada garam yang terbentuk pada asam lemah dengan basa kuat atau garam dari basa lemah dengan asam kuat. Yang termasuk garam yang terhidrolisis parsial adalah pilihan no 1 dan 3. Natrium asetat (CH3COONa) berasal dari CH3COOH (asam lemah) dan NaOH (basa kuat) yang mengalami hidrolisis hanya ion CH3COO−. Sedangkan Ammonium klorida (NH4Cl) berasal dari NH4OH (basa lemah) dan HCl (Asam kuat) yang mengalami hidrolisis hanya ion NH4+
Jawaban B
Pembahasan Dalam Bentuk Video:
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Gimana belajar hidrolisis nya, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Ok demikian rangkuman materi dan contoh soal hidrolisis berikut video pembelajaran dan latihan soalnya. Semoga berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.
Semoga Bermanfaat